Biodisponibilidad de ácido acetil salicílico in vitro
Trabajo participante en el evento: “Odontópicos” Oruga de Plata Julio-Diciembre 2013.
Resumen
Se realizó un estudio de biodisponibilidad in vitro de tres formulaciones de ácido acetilsalicílico, se utilizaron presentaciones farmacéuticas en forma de tabletas producidas por tres laboratorios diferentes (genérico, similar y de patente). Se realizó una simulación farmacocinética monitoreando el fármaco durante 100 minutos, midiéndose los niveles de ácido salicílico simulados en muestras de plasma y de orina por, espectrofotometría a una longitud de onda de 230 nm. Se determinó la cantidad de ácido salicílico total excretado en muestras simuladas de orina (E∞), la cantidad acumulada de la dosis del fármaco recuperada a los 100 minutos (%R100), las constantes cinéticas de absorción (ka) y de eliminación (ke), el ABC0∞, Tmáx, Cpmáx y la Biodisponibilidad. Todos estos datos se compararon con los valores obtenidos en las tres formulaciones presentadas de los parámetros obtenidos experimentalmente. Se analizó estadísticamente cada parámetro mediante el método de ANOVA y se compararon los datos por el método de comparación múltiple de la Mínima Diferencia Significativa (LSD) para un nivel de significación de p < 0.05, hallándose diferencias significativas entre las diferentes formas farmacéuticas, concluyéndose que si son biodisponibles.
Palabras clave: Ácido Acetilsalicílico, Biodisponibilidad, tabletas, Excreción Urinaria, In vitro.
Abstract
In vitro biodisponibility of three oral formulations of Acetylsalicylic acid, used pharmaceutics tablets developed for three laboratories (generic, similar and patent). This study to realize follow in vitro pharmacokinetic simulation monitored for 100 minutes the levels of salicylic acid in plasma and in urine having been measure by spectrophotometry to 270 nm. A determination was made of the total quantify excreted (E∞), of the accumulated amount of the dose of drug recovered in urine after of 100 minutes (%R100), and of the kinetics constants of absortion (ka) and elimination (ke), under curve area (AUC), Tmax, Cpmax and biodisponibility. These data were confront with the values obtained within the same parameters, from tablets other formulations for comparative purposes. Each significant Difference (LSD) for a level of significance of p < 0.05, significant differences having been found between pharmaceutics forms. That is why it was concluded are biodisponibilit.
Keywords: Acetylsalicylic acid, Biodisponibility, Tablets, Urinary Excretion, In Vitro.
Introducción
El efecto clínico de un fármaco puede ser modificado en forma significativa por la velocidad y magnitud de la absorción, es decir en la biodisponibilidad. Un factor importante de modificación es el referido a las formas farmacéuticas sólidas, donde es considerable su incidencia en la liberación del principio activo. (1)
Se han estudiado diferentes formulaciones de ácido acetilsalicílico para medir la liberación del principio activo, pero dado que es un fármaco muy utilizado en la clínica pueden presentarse diferencias en la absorción del mismo referidas a la respuesta de sujeto a sujeto es decir a la variabilidad biológica. Es importante conocer que su costo es variable dependiendo del laboratorio que lo produce, por lo cual es necesario la biodisponibilidad del fármaco independientemente del costo del mismo.
Uno de los efectos indeseables del AAS es la irritación en la mucosa gástrica debida a los cristales que se producen (2). Por esta razón se han presentado diferentes formulaciones entéricas en el mercado para disminuir este efecto adverso, aunque las tabletas se siguen utilizando. Así, la forma farmacéutica elegida para administrar los fármacos tiene fundamental importancia en la acción que éstos producen (3). Después de ser administrado en el organismo en forma oral, el ácido acetilsalicílico es absorbido en el tracto gastrointestinal dando lugar a su metabolito activo principal: el ácido salicílico. Los níveles plasmáticos máximos se alcanzan de 10 a 20 minutos para el ácido acetilsalicílico y de 18 minutos a 2 horas para el ácido salicílico. La vida media de eliminación varía de 2 a 3 horas y el fármaco y sus metabolitos son excretados por vía renal (4).
El objetivo de este trabajo es evaluar tres formulaciones orales en forma de tabletas de AAS cuyas formulaciones son producidas por diferentes laboratorios farmacéuticos (genérico, similares y de patente).
Con la finalidad de establecer un parámetro comparativo de ensayó respecto a los parámetros farmacocinéticos de absorción y de eliminación para establecer la biodisponibilidad de las diferentes formulaciones. Del análisis farmacocinético se establecen los siguientes parámetros: la constante de velocidad de absorción (ka), la constante de velocidad de eliminación (ke), el tiempo de vida media de absorción (t1/2absorción) y tiempo de vida media de eliminación (t1/2eliminación).
A fin de establecer la bioequivalencia in vitro de las formulaciones en estudio se compararon los valores del porcentaje acumulado de la dosis de AAS recuperado en orina a diferentes tiempos (%R) y los valores de la cantidad total de fármaco excretado en orina a partir de los datos de excreción urinaria (E∞).
Objetivo general
Representar la simulación de un modelo abierto de un compartimiento (MAUC), utilizando una dosis única del fármaco Ácido Acetilsalicílico (AAS) en agua para determinar la biodisponibilidad del fármaco in vitro.
Objetivos específicos
- Diseñar un equipo de Mariotte que represente el MAUC i.v. en agua.
- Ajustar las condiciones de muestreo para la simulación del MAUC i.v. de AAS en agua.
- Determinar los parámetros farmacocinéticos después de administrar una dosis conocida de AAS en un sistema farmacocinético de simulación in vitro.
- Reportar el perfil farmacocinético del AAS con los datos obtenidos de concentración plasmática (Cp) en función del tiempo siguiendo un modelo abierto de un compartimiento con eliminación de primer orden.
- Determinar la cantidad excretada del fármaco AAS en muestras simuladas de orina.
MÉTODOS Y MATERIALES
FORMULACIÓN 1 (Patente):
AAS…………………………………………………………… 300 mg
Excipiente cbp……………………………………………………1 tableta
FORMULACIÓN 2 (Genérico):
AAS…………………………………………………………… .300 mg
Excipiente cbp……………………………………………………1 tableta
FORMULACIÓN 3 (Similar):
AAS…………………………………………………………… 300 mg
Excipiente cbp……………………………………………………1 tableta
| Material | ||
| Espectrofotómetro UV-visible | - | 1 |
| Celdas de cuarzo | - | 2 |
| Balanza analítica | - | 1 |
| Tubos de ensayo | 13 x 100 | 20 |
| Vasos de precipitados de vidrio | 50 ml | 5 |
| Vasos de precipitados de vidrio | 100 ml | 5 |
| Pipeta volumétricas | 3 ml | 4 |
| Matraz de vástago | 250 o de 500 ml | 1 |
| Vidrio de reloj | - | 1 |
| Espátula acanalada | - | 1 |
| Piseta | - | 1 |
| Gradilla | - | 1 |
| Probeta graduada | 250 ml | 1 |
| Reactivos | - | 50 mg |
| Agua destilada | - | - |
| Estándar de ácido salicílico Tabletas de ácido acetil salicilico |
||
| Material por equipo | ||
| Botella de Mariotte | - | 1 |
Procedimiento para realizar la simulación de AAS in vitro
- Por equipo diseñar una botella de mariotte (envase de plástico de aproximadamente 4 L unida a un sistema de venoclisis en la parte inferior de la misma). Llenar este contenedor con aproximadamente 3.5 L de agua de la llave.
- Colocar el soporte universal y ayudándose de las pinzas de nuez sujetar el matraz de vástago y sostenerlo al mismo tiempo sobre la superficie de un agitador magnético (parrilla magnética).
- Colocar una probeta graduada de 250 ml en la salida del matraz de vástago para recolectar la muestra.
- Colocar la botella de mariotte a una distancia tal en la que el flujo del agua caiga sobre el matraz de vástago para hacer fluir el agua. Ajustar la velocidad de flujo en cuanto se abra el sistema de venoclisis a 25 ml/min.
- Pesar una tableta de 300 mg de AAS y colocar la tableta en el matraz de vástago cuando la velocidad de flujo ya esté controlada. Se homogeniza la solución y se mantiene en continua agitación con el fin de mantener un sistema dinámico.
- Cuando el fármaco se encuentre en el matraz de vástago abrir el sistema de venoclisis y comenzar a contar los tiempos de muestreo (5, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90 y 100 min) y tomar la muestra respectiva.
- Tomar 2 muestras: en un tubo de ensaye tomar la muestra correspondiente a las concentraciones plasmáticas (Ac) al tiempo 10 minutos y enseguida tomar la muestra correspondiente a la muestra de orina (Au) de los 10 minutos (la que se obtienen en la probeta). Medir el volumen obtenido a este tiempo y anotarlo.
- Realizar lo mismo para los tiempos posteriores y en cuanto se obtengan las muestras leer la absorbancia correspondiente en el espectrofotómetro utilizando celdas de cuarzo a una longitud de onda de 270 nm. Utilizar como blanco una solución de agua destilada.
- Recopilar la absorbancia obtenida para posterior análisis.
- Graficar el perfil farmacocinético obtenido.
RESULTADOS
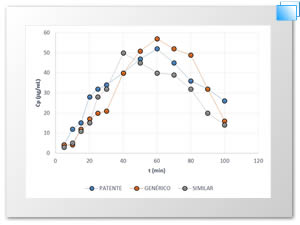
En la Figura 1 se muestra el perfil farmacocinético obtenido de la simulación in vitro del ácido acetilsalicilico.
Figura 1. Perfil farmacocinético del comportamiento del ácido acetilsalicilico in vitro.
En la TABLA 1 se muestran los parámetros obtenidos a partir de una simulación del modelo abierto de un compartimiento (MAUC i.v.) para un estudio de la biodisponibilidad del ácido acetilsalicílico in vitro.
| PARÁMETROS FARMACOCINÉTICOS | PATENTE | GENÉRICO | SIMILAR |
| ka (min-1) | 0.075 | 0.072 | 0.1108 |
| ke (min-1) | 0.0172 | 0.0302 | 0.0203 |
| t1/2 absorción | 9.2419 | 9.627 | 6.2558 |
| t1/2 eliminación | 40.2992 | 22.9519 | 34.1452 |
| ABC0¥ | 2112 | 903 | 1022 |
| Tmáx | 60 | 60 | 60 |
| Cpmáx | 52 | 57 | 50 |
| Biodisponibilidad (F) | 0.4274 | 0.4839 | |
| %R | 36.38 | 33.28 | 31.53 |
Tabla 1. Parámetros obtenidos de la simulación del modelo abierto de un compartimiento (MAUC) para determinar la biodisponibilidad del ácido acetilsalicílico in vitro.
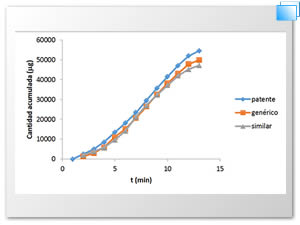
En la Figura 2 se muestra el comportamiento del fármaco respecto a la cantidad acumulada en el sistema in vitro.
Figura 2. Cantidad acumulada del ácido acetilsalicilico in vitro.
CONCLUSIONES
A partir de las propiedades del fármaco del ácido acetilsalicílico se pudo realizar una simulación in vitro en agua siguiendo un modelo abierto de un compartimento con eliminación de primer orden con el fin de determinar la biodisponibilidad del fármaco comparando su comportamiento del mismo mediante la simulación, utilizando la misma presentación comercial (tabletas de 300 mg) producida por tres laboratorios farmacéuticos diferentes para comprobar si independientemente del costo del medicamento se podría utilizar. Como no existe diferencia significativa entre los resultados obtenidos de biodisponibilidad de las diferentes formulaciones concluimos que se pueden utilizar las presentaciones de genéricos, las de patente y la de los laboratorios similares.
Bibliografía
1. Cárcamo Cid E. Introducción a la Farmacocinética. Revista Farmacéutica, 1988; 130: 27-33.
2. Blase CM, Peck GE. Biodisponibility. Drug Develop Ind Pharm, 1992; 18. 869-893.
3. OMS. Biodisponibilidad de los Medicamentos. Principios y problemas. Organización Mundial de la Salud. Ginebra, 1974; 536.
4. . OMS. Biodisponibilidad de los Medicamentos. Principios y problemas. Organización Mundial de la Salud. Ginebra, 20044; 536.
[a]Profesor Investigador de la Univeridad Autónoma del Estado de Hidalgo.
[b] Alumno de la Universidad Autónoma del Estado de Hidalgo.